
摘要:[目的]寻找一种广谱高效的合成N1-取代吡唑类中间体的新方法。[方法]以溴化镍、4,5-双二苯基膦-9,9-二甲基氧杂蒽和2,4,6-三甲基苯基溴化镁合成一种在空气中稳定的催化剂,通过该催化剂催化1H-吡唑与卤代芳杂环化合物生成N1-取代的吡唑类化合物。[结果]通过优化确定了最佳反应条件,一步反应,收率为30.2%~95.7%,化合物结构及催化剂结构均经过1H NMR确认。[结论]该催化剂可有效催化1H-吡唑与卤代芳杂环的合成,尤其对反应活性较低的氯取代芳环具有高效的催化作用,反应条件温和。催化剂所用原料廉价易得,制备简单且在空气环境下稳定。
吡唑类化合物作为含氮杂环体系中的重要一员,不但具有独特的结构形式,而且具有广谱的生物活性,在杀虫、除草、杀菌及抗癌等方面发挥着重要的作用。其中,以N1-取代的吡唑类化合物在农药和医药领域更是有着广泛的应用,如1979年巴斯夫公司上市的吡唑类除草剂吡草胺(metazachlor);1989年法国罗纳-普朗克公司开发的广谱杀虫剂氟虫腈(fripronil);1999年美国Searle制药厂研发上市用于治疗风湿性、类风湿性及骨关节炎的塞来考昔(celecoxib);2001年Selwood等报道的具有活化可溶性钠尿肽鸟苷酸环化酶以及抑制血小板凝结的芳基取代吡唑类化合物等。
目前N1-取代吡唑类化合物的制备通常由β-酮基酯及类似物与肼类衍生物合成,该方法虽方便易行但过程过于繁琐,不利于反应的多样化。2017年Adrian等提出一种无催化剂生成N1-取代的吡唑类衍生物的方法,该方法虽然高效但对反应物的要求苛刻,仅适用于3位强吸电子基团取代的吡唑类化合物与氟取代或个别溴取代的芳环或杂环的合成,生产成本高,所适用的范围窄。因此,开发了一种广谱高效且廉价易得的催化合成N1-取代吡唑类中间体的催化剂。
1 实验部分
1.1 试剂与仪器
试剂:4,5-双二苯基膦-9,9-二甲基氧杂蒽、吡唑、苄氯、苄溴、对氯硝基苯、3-硝基吡唑、3-三氟甲基吡唑、4-硝基吡唑(南京协尊化工有限公司),对硝基氯化苄(阿达玛斯试剂有限公司),3-甲基吡唑(安耐吉化学试剂有限公司),溴化镍(麦克林化学试剂有限公司),2,4,6-三甲基苯基溴化镁(阿拉丁试剂有限公司)。无水乙醇、二氯甲烷、石油醚、乙醚、四氢呋喃等均为分析纯。
仪器:SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司),R-300旋转蒸发仪(瑞士布奇公司)。
1.2 实验部分
1.2.1 催化剂的合成方法
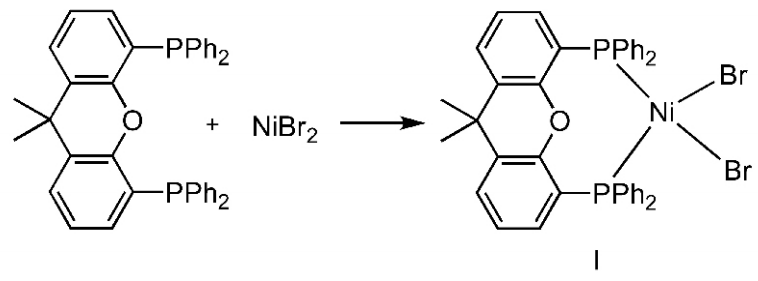
将10 mmol溴化镍放入烘干的三颈圆底烧瓶中,加入60 mL无水乙醇,随后加入10 mmol 4,5-双二苯基膦-9,9-二甲基氧杂蒽。在氮气条件下加热回流30 min后,冰浴条件下冷却至0℃。抽滤,依次用冷的无水乙醇、乙醚各冲洗3次。最后用二氯甲烷冲洗,收集冲洗液,旋干得深绿色固体——结构式(Ⅰ)所示化合物,收率为89.6%。
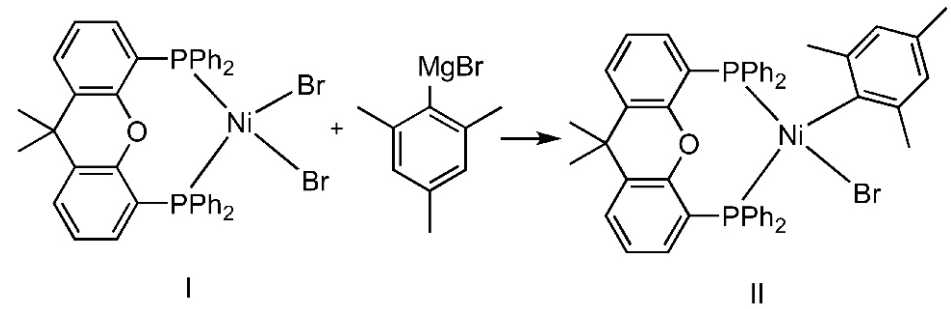
在氮气条件下,将8 mmol的结构式(Ⅰ)所示化合物与40 mL干燥处理后的四氢呋喃加入干燥的圆底烧瓶中,在0℃下滴加8 mmol 2,4,6-三甲基苯基溴化镁。滴加完毕后,升至室温,反应0.5 h。旋干溶剂,加入30 mL冷的无水乙醇,抽滤,依次用冷的无水乙醇、石油醚各冲洗3次。最后用二氯甲烷冲洗,收集冲洗液,旋干后得红棕色固体——结构式(Ⅱ)所示催化剂,收率为97.2%。1H NMR(600 MHz,CDCl3) δ:7.63~7.62(m,2H),7.26~7.16(m,18H),7.08(t,J=7.2 Hz,8H),2.03(s,3H),1.79(s,6H),1.65(dd,J=14.6,6.4 Hz,3H),1.54(s,3H)。
1.2.2 催化剂催化N1-取代吡唑衍生物的合成
(1)在回流条件下催化氯化苄与吡唑
在圆底烧瓶中加入6.58 g吡唑、3.4 g氯化苄、0.84 g结构式(Ⅱ)所示催化剂、5.52 g叔丁醇钾、70 mL四氢呋喃,氮气条件下加热回流7 h。过滤,滤液旋干后过柱[乙酸乙酯∶石油醚(v/v)=1∶4],得6.60 g无色液体,收率为83.4%。1H NMR(600 MHz,CDCl3) δ:7.54(d,J=1.5 Hz,1H),7.37(d,J=2.2 Hz,1H),7.34~7.31(m,2H),7.29(d,J=7.2 Hz,1H),7.20~7.19(m,2H),6.27(t,J=2.1 Hz,1H),5.31(s,2H)。
(2)在回流条件下催化氯化苄与3-硝基吡唑
在圆底烧瓶中加入0.57 g 3-硝基吡唑、0.89 g氯化苄、0.21 g结构式(Ⅱ)所示催化剂、0.56 g叔丁醇钾、50 mL四氢呋喃,氮气条件下加热回流7 h。过滤,滤液旋干后过柱[乙酸乙酯∶石油醚(v/v)=1∶2],得0.73 g黄色液体,收率为71.9%。1H NMR(600 MHz,CDCl3) δ:7.39~7.38(m,4H),7.29(d,J=6.5 Hz,2H),6.90~6.89(m,1H),5.37(s,2H)。
(3)在回流条件下催化氯化苄与3-三氟甲基吡唑
在圆底烧瓶中加入1.70 g 3-三氟甲基吡唑、2.00 g氯化苄、0.42 g结构式(Ⅱ)所示催化剂、1.40 g叔丁醇钾、60 mL四氢呋喃,氮气条件下加热回流7 h。过滤,滤液旋干后过柱[乙酸乙酯∶石油醚(v/v)=1∶2],得2.66 g浅黄色液体,收率为94.1%。1H NMR(600 MHz,CDCl3) δ:7.36~7.34(m,5H),7.22(s,1H),6.52(d,J=2.2 Hz,1H),5.33(s,2H)。
(4)在回流条件下催化氯化苄与3-甲基吡唑
在圆底烧瓶中加入0.41 g 3-甲基吡唑、0.89 g氯化苄、0.21 g结构式(Ⅱ)所示催化剂、0.56 g叔丁醇钾、50 mL四氢呋喃,氮气条件下加热回流7 h。过滤,滤液旋干后过柱[乙酸乙酯∶石油醚(v/v)=1∶2],得0.75 g黄色液体,收率为87.2%。1H NMR(600 MHz,CDCl3) δ:7.33~7.24(m,4H),7.18(d,J=7.2 Hz,1H),7.07(d,J=7.4 Hz,1H),6.04(dd,J=9.0,1.3 Hz,1H),5.25(d,J=30.9 Hz,2H),2.29(s,2H),2.19(s,1H)。
(5)在回流条件下催化氯化苄与4-硝基吡唑
在圆底烧瓶中加入0.57 g 4-硝基吡唑、0.89 g氯化苄、0.21 g结构式(Ⅱ)所示催化剂、0.56 g叔丁醇钾、50 mL四氢呋喃,氮气条件下回流5 h。过滤,滤液旋干后过柱[乙酸乙酯∶石油醚(v/v)=1∶2],得0.98 g黄色液体,收率为95.7%。1H NMR(600 MHz,CDCl3) δ:8.07(d,J=17.1 Hz,2H),7.40~7.35(m,4H),7.29(d,J=2.0 Hz,1H),5.30(s,2H)。
(6)在回流条件下催化对硝基氯化苄与吡唑
在圆底烧瓶中加入0.34 g吡唑、1.03 g对硝基氯化苄、0.21 g结构式(Ⅱ)所示催化剂、0.56 g叔丁醇钾、50 mL四氢呋喃,氮气条件下回流7 h。过滤,滤液旋干后过柱[乙酸乙酯∶石油醚(v/v)=1∶2],得0.95 g黄色固体,收率为93.6%。1H NMR(600 MHz,CDCl3) δ:8.17(d,J=8.7 Hz,2H),7.61(s,1H),7.59(d,J=1.3 Hz,1H),7.48(d,J=2.2 Hz,1H),6.35(d,J=2.0 Hz,2H),5.44(s,2H)。
(7)在回流条件下催化对氯硝基苯与吡唑
在圆底烧瓶中加入0.68 g吡唑、1.58 g对氯硝基苯、0.42 g结构式(Ⅱ)所示催化剂、1.35 g叔丁醇钾、50 mL四氢呋喃,氮气条件下回流7 h。过滤,滤液旋干后过柱[乙酸乙酯∶石油醚(v/v)=1∶2],得0.57 g黄色油状液体,收率为30.2%。1H NMR(600 MHz,CDCl3) δ:8.34(d,J=9.2 Hz,2H),8.04(d,J=2.5 Hz,1H),7.89(d,J=9.2 Hz,2H),7.80(d,J=1.4 Hz,1H),6.56(dd,J=2.5,1.8 Hz,1H)。
2 讨论与结果
2.1 催化剂对卤代芳杂环的适用范围
该催化剂对各类卤素取代的芳杂环均具有良好的催化活性,即使对于反应活性较低的氯取代芳杂环也仍有很好的催化效率,而对于反应活性稍强于氯取代的溴取代芳杂环,常温下即可获得良好收率(表1)。
表1 催化剂对吡唑与各类卤代芳环反应的催化活性

2.2 催化剂对吡唑类化合物的适用范围
该催化剂对吡唑类化合物并无明显的限制,无论3位或4位含取代基的吡唑类化合物还是3位上具有吸电子或供电子基团,均表现出良好的催化活性,收率上无明显差异(表2)。
表2 催化剂对氯化苄与各类吡唑类化合物的催化活性

2.3 碱对催化活性的影响
对于在回流条件下催化氯化苄与吡唑,在相同的反应条件下,叔丁醇钾相比甲醇钠而言更能促进催化剂的催化活性(表3)。
表3 碱对催化活性的影响

2.4 催化剂对反应活性的影响
在相同的反应条件下,吡唑与各类卤代芳环在不添加催化剂时,反应收率大大降低,甚至几乎无反应活性(表4)。
表4 催化剂对反应活性的影响

3 结论
(1)通过溴化镍、4,5-双二苯基膦-9,9-二甲基氧杂蒽和2,4,6-三甲基苯基溴化镁在温和的条件下制得该催化剂,该催化剂在空气中稳定且催化反应条件温和、催化活性良好。
(2)该催化剂对吡唑类化合物无明显的限制条件,无论是对吸电子基团还是供电子基团取代的吡唑类化合物,均无明显差异化的收率,且收率较高;对卤代芳杂环,即使反应活性较低的氯取代化合物也仍有良好的催化活性,而不同类型的卤代芳环虽收率上有所差异,但仍具有不低的催化活性。
(3)该催化剂适用范围广,反应温度在室温至回流条件下均具有良好的催化活性,但催化反应所使用的碱对催化活性影响较大,相比于甲醇钠,叔丁醇钾更能提高催化剂的催化效率。
来源:朱琳娜1,2, 王嫱2, 于海波2, 姜鹏2. 农药, 2019, 58(5): 324-326
作者单位介绍:1 沈阳化工研究院;2 沈阳中化农药研发有限公司