
氟吡菌酰胺(fluopyram,图1B)是由拜尔作物科学公司开发,于2010年在中国获得临时登记用于黄瓜白粉病防治,可对灰霉病菌、白粉病菌、核盘菌属以及丛梗孢属病菌有较好的防治效果;2012年在中国登记了41.7%氟吡菌酰胺制剂农药,用于线虫防治。氟吡菌酰胺(路富达)作为一种新型的杀线虫剂,作用机制为抑制靶标线粒体呼吸链复合体II(琥珀酸脱氢酶,SDH)的活性,从而干扰线虫的呼吸作用,使其虫体僵直,活动力急剧下降,进而导致线虫死亡。氟吡菌酰胺(路富达)也是第一个通过抑制琥珀酸脱氢酶的杀线虫剂,因其具有低毒、环保、高效、多功能性等优点,有望成为线虫防治战略中的支柱产品。
琥珀酸脱氢酶是三羧酸(TCA)循环中唯一整合在膜上的多亚基酶。在真核生物中,它结合在线粒体的内膜上;而在原核生物中,它整合在细胞膜上。它是连接氧化磷酸化和电子转移的枢纽之一,可以为真核细胞线粒体、各种原核细胞的需氧及产能呼吸链提供电子。琥珀酸脱氢酶抑制剂(SDHI)通过抑制呼吸链电子传递,从而破坏线粒体的三羧酸循环,进而导致线粒体不能够产生能量,最终导致病原体死亡。自20世纪60年代第一个琥珀酸脱氢酶抑制剂萎锈灵上市以来,已有23种以SDH为靶标的杀菌剂陆续上市(如图1B所示),其销售额在农药杀菌剂领域占据重要比重,这些杀菌剂在分子结构上均具有酰胺键。其中,氟吡菌酰胺因兼具良好的杀菌以及杀线虫活性,受到了广泛的关注。因此,近些年来以氟吡菌酰胺为先导化合物开展靶向SDH酶的杀菌剂和杀线虫剂的分子设计,成为了研究热点。双酰胺衍生物在医药和农药中具有重要作用,它们具有广谱的生物活性,如抗细菌、抗真菌、除草、杀虫等活性。如氯虫苯甲酰胺(chlorantraniliprole,图1A)是一种靶向鱼尼丁受体的高效广谱杀虫剂。根据前期对氟吡菌酰胺与靶酶的结合方式研究发现,SDH具有“L”型“长”的疏水的活性口袋,吡啶环与Trp67形成π-π相互作用,酰胺的氧与Pro211形成氢键相互作用。
为了寻找结构新颖的杀菌杀线虫小分子先导化合物,本文以氟吡菌酰胺为骨架,保留氟吡菌酰胺的吡啶与酰胺键片段,结合双酰胺结构衍生物良好生物活性,通过亚结构拼接方法,设计并合成了一种新型的含双酰胺结构的氟吡菌酰胺衍生物(图2)。
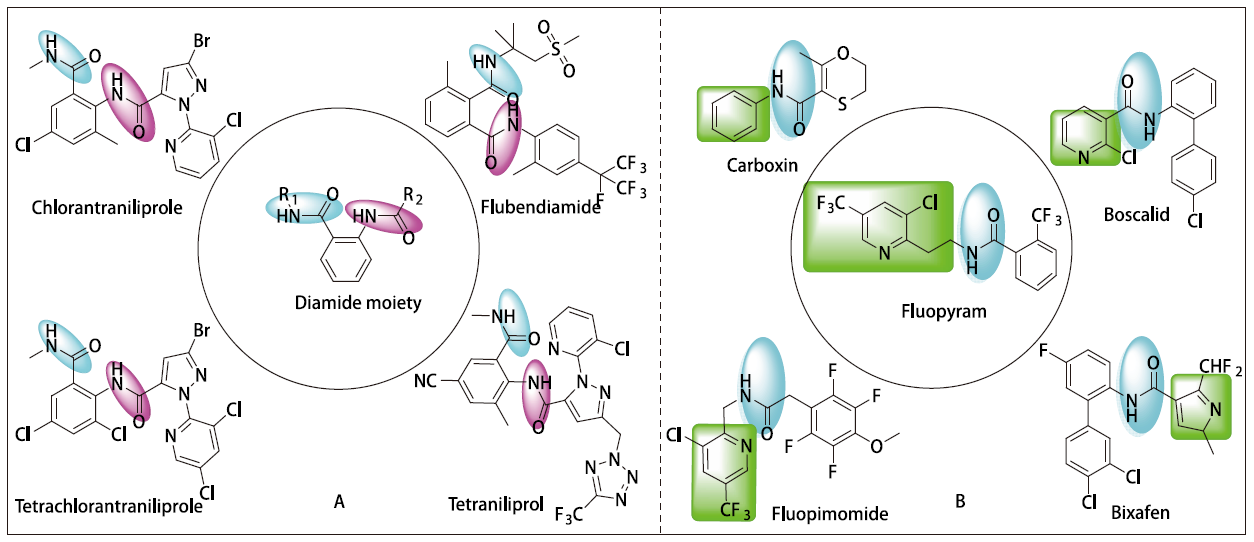
图 1 部分双酰胺类杀虫剂及SDHI类杀菌剂
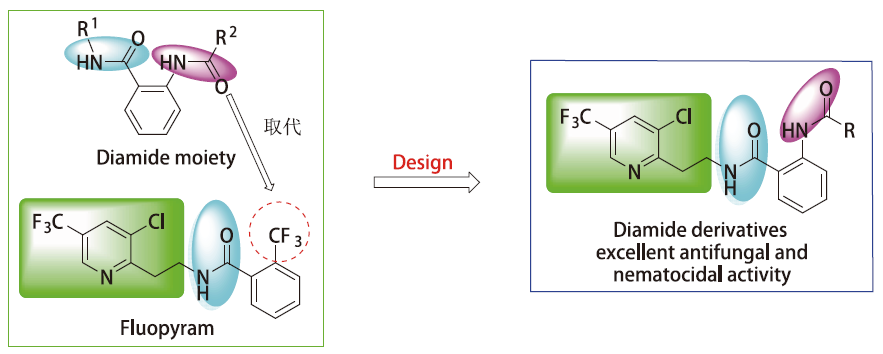
图 2 目标化合物的设计
1 结果与讨论
1.1 化学合成
设计的目标化合物合成过程如图3所示。首先以2,3-二氯-5-三氟甲基-吡啶(1)为起始原料,将其溶于二甲基亚砜(DMSO)中,以无水碳酸钾作碱,氰基乙酸乙酯作亲核试剂,在70℃反应6 h后经薄层色谱(TLC)检测反应完成,反应液冷却至室温后,用稀盐酸溶液调节pH为2,有大量黄色固体析出,过滤收集滤饼,得到化合物2。
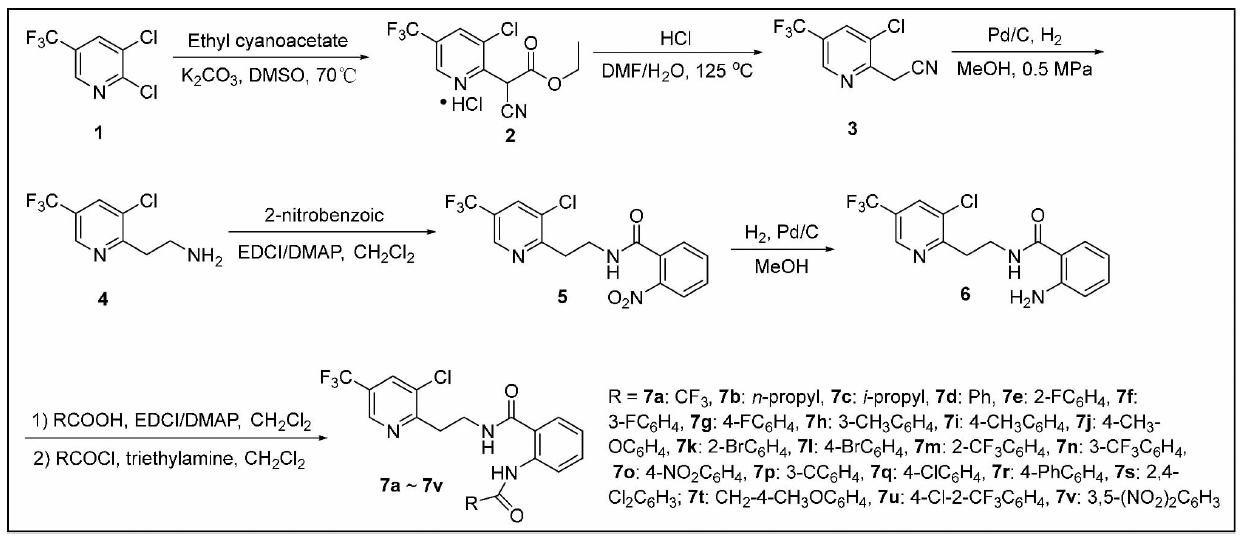
图 3 目标化合物的合成
将化合物2溶于N,N-二甲基甲酰胺(DMF)中,用稀盐酸溶液调节pH为2,采用温度为130℃,并且加入大量DMF,导致后处理困难。本文采用水和DMF作混合溶剂,在125℃下反应4 h,经TLC检测反应结束,冷却至室温,用4 mol/L的NaOH溶液调节pH为9,用水稀释反应液后用乙酸乙酯萃取,经柱层析分离得到化合物3。
将化合物3溶解在甲醇中,加入溴代四丁基铵(TBAB)、浓硫酸、10% Pd/C,在0.5 MPa下反应2 h,经TLC检测反应完成,过滤浓缩得到粗产物4。与文献相比,粗产物4可以不经过柱层析提纯,直接经过甲醇/无水乙醚体系进行重结晶,实验室中一次可以制备50 g级的化合物4,大大节约了时间。将化合物4溶解在无水二氯甲烷中,加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI)、4-二甲氨基吡啶(DMAP)以及邻硝基苯甲酸进行缩合反应得到中间体5,中间体5可以不经过分离提纯直接进行硝基的还原得到6。化合物7a~7c是中间体6与相应取代酰氯反应制得,其余目标化合物均为中间体6与相应取代羧酸在EDCI/DMAP缩合体系下进行酰胺化制得,该法所得双酰胺产物易于提纯,部分化合物用甲醇重结晶即可。
1.2 波谱分析
以化合物7a为例,分子结构式为C17H12ClF6N3O2,对化合物的1H NMR、13C NMR数据进行分析。化学位移δ12.89的单峰归属为三氟甲基附近CONH的活泼氢,化学位移δ8.86的单峰归属为吡啶环的氢,化学位移δ8.60~8.53的多重峰归属为吡啶环的氢,δ7.61的单峰归属为剩余酰胺键的活泼氢,δ4.00(dd,J=11.8,5.9 Hz)归属为临近吡啶环的亚甲基,δ3.34(t,J=5.8 Hz)的三重峰则归属为另一个亚甲基。通过13C NMR可知,δ36.7与δ33.6为两个亚甲基的碳。δ167.9与160.5则归属为两个酰胺键的羰基碳,δ125.6、124.1、120.5、117.4归属为三氟甲基中碳的信号峰。
1.3 杀线虫活性测定
目标化合物7a~7v的杀线虫活性见表1,以氟吡菌酰胺为阳性对照。在200 mg/L浓度下测定了化合物的杀线虫活性。化合物7f、7p和7s(表1)表现出良好的杀线虫活性,抑制率分别为87%、76%和81%。当吸电子基团如卤原子取代苯环时,化合物7f(3-F)、7g(4-F)、7p(3-Cl)、7s(2,4-Cl2)均表现出70%以上的致死活性,其中,位于间位的氟(7f,3-F)表现出良好的抑制活性,说明间位有利于生物活性的提高。例如,化合物7p(3-Cl)和7q(4-Cl)的对线虫的致死率分别为76%和47%。
表 1 目标化合物对秀丽隐杆线虫的杀线虫活性(200 mg/L)
|
化合物 |
R |
死亡率/% |
化合物 |
R |
死亡率/% |
|
7a |
CF3 |
20 |
7m |
2-CF3C6H4 |
55 |
|
7b |
n-Propyl |
45 |
7n |
3-CF3C6H4 |
10 |
|
7c |
i-Propyl |
45 |
7o |
4-NO2C6H4 |
15 |
|
7d |
Ph |
50 |
7p |
3-ClC6H4 |
76 |
|
7e |
2-FC66H4 |
55 |
7q |
4-ClC6H4 |
47 |
|
7f |
3-FC6H4 |
87 |
7r |
4-PhC6H4 |
0 |
|
7g |
4-FC6H4 |
70 |
7s |
2,4-C12C6H4 |
81 |
|
7h |
3-CH3C6H4 |
60 |
7t |
CH2-(4-OCH3)C6H4 |
70 |
|
7i |
4-CH3C6H4 |
0 |
7u |
4-Cl-2-CF3C6H4 |
50 |
|
7j |
4-CH3OC6H4 |
0 |
7v |
3,5-(NO2)2C6H4 |
66 |
|
7k |
2-BrC6H4 |
30 |
Fluopyram |
/ |
100 |
|
7l |
4-BrC6H4 |
20 |
/ |
/ |
/ |
1.4 抑菌活性测定
目标化合物7a~7v对苹果腐烂病原菌、苹果轮纹病原菌、番茄灰霉病原菌、油菜菌核病原菌在浓度50 mg/L时的抑制菌丝生长速率结果如表2所示。由表2可知,在50 mg/L浓度下,大多数化合物都有显著的抑菌活性,其中对油菜菌核病原菌均具有显著的抑菌活性,大于80%。化合物7d、7f、7h、7i、7n对苹果腐烂病原菌的抑制活性超过了80%,但仍低于对照药剂氟吡菌酰胺,其中化合物7f的抑制活性达到92.5%,接近阳性对照。值得一提的是,化合物7d、7f、7i对四种病原菌均表现出较为优异的抑制活性,对普筛活性较高的化合物进行了EC50的测定,结果如表3所示。化合物7d、7f、7i对苹果腐烂病原菌的EC50分别为7.39、6.12、16.4 mg/L,对苹果腐烂菌有较强的抑制活性,并且三种化合物的抑制活性均高于阳性对照氟吡菌酰胺(35.5 mg/L)。
通过对活性的分析得知,当苯环上引入给电子基团时会降低杀菌活性,如当引入烷氧基后对苹果腐烂病原菌的活性会有所降低(7j<7d)。如果苯环引入过大的疏水基团时会使得活性下降(7r,22.8%)。当苯环上引入氟原子后会对活性有所改善(7f>7d),推测可能是由于氟原子的电负性使得苯环电子云密度降低导致活性有所提高。并且间位取代相对于对位和邻位取代会对活性有较大提高(7f>7e>7g)。这些结果表明目标化合物的抑菌活性是多种因素的共同作用。
表 2 目标化合物对4种植物病原菌的抑制率(50 mg/L)
|
化合物 |
抑制率(防效)/% | |||
|
苹果腐烂病原菌 |
苹果轮纹病原菌 |
番茄灰霉病原菌 |
油菜菌核病原菌 | |
|
7a |
73.3 |
37.6 |
13.9 |
81.3 |
|
7b |
73.3 |
16.1 |
36.1 |
72.9 |
|
7c |
55.0 |
30.6 |
34.7 |
72.9 |
|
7d |
89.4 |
55.9 |
41.7 |
88.2 |
|
7e |
43.9 |
14.0 |
0 |
15.3 |
|
7f |
92.5 |
53.8 |
55.6 |
88.9 |
|
7g |
23.9 |
22.0 |
5.6 |
5.6 |
|
7h |
84.4 |
2.7 |
4.9 |
69.4 |
|
7i |
84.4 |
33.9 |
45.1 |
88.9 |
|
7j |
79.4 |
32.8 |
55.6 |
90.3 |
|
7k |
19.4 |
0 |
0 |
0 |
|
7l |
62.2 |
10.8 |
10.0 |
85.4 |
|
7m |
40.6 |
37.6 |
22.2 |
87.5 |
|
7n |
84.4 |
2.7 |
4.9 |
69.4 |
|
7o |
21.1 |
0 |
13.9 |
82.6 |
|
7p |
65.0 |
0 |
54.5 |
32.5 |
|
7q |
36.7 |
19.9 |
36.8 |
77.8 |
|
7r |
22.8 |
8.1 |
0 |
12.5 |
|
7s |
60.6 |
5.9 |
0 |
81.9 |
|
7t |
61.1 |
34.9 |
0 |
14.6 |
|
7u |
28.3 |
7.0 |
18.1 |
2.8 |
|
7v |
34.4 |
15.1 |
0 |
80.6 |
|
Fluopyram |
95.0 |
90.0 |
91.0 |
92.0 |
表 3 化合物7d、7f、7i以及氟吡菌酰胺对苹果腐烂病原菌的EC50
|
Compd. |
EC50/(mol•L-1) |
Equation |
R2 |
|
7d |
7.39 |
y=1.4509x+3.74 |
0.98 |
|
7f |
6.12 |
y=1.971x+3.3379 |
0.99 |
|
7i |
16.4 |
y=0.8564x+3.9593 |
0.99 |
|
Fluopyram |
35.5 |
y=1.8794x+2.0858 |
0.99 |
1.5 酶活性测定
为了确定目标化合物对琥珀酸脱氢酶的抑制活性,在100 μmol/L的浓度下对化合物7a~7v对苹果腐烂病原菌的琥珀酸脱氢酶的抑制活性进行了测定,结果如图3所示。从图4可以看出,目标化合物均表现出中等的酶抑制活性. 其中化合物7f的抑制率达到90.1%,接近于对照药剂氟吡菌酰胺. 并且通过对比酶活性与抑菌活性发现,化合物的酶抑制活性趋势与抑制苹果腐烂病原菌活性趋势相近,表明所制备化合物可以通过抑制病原真菌的呼吸作用从而达到杀菌作用。
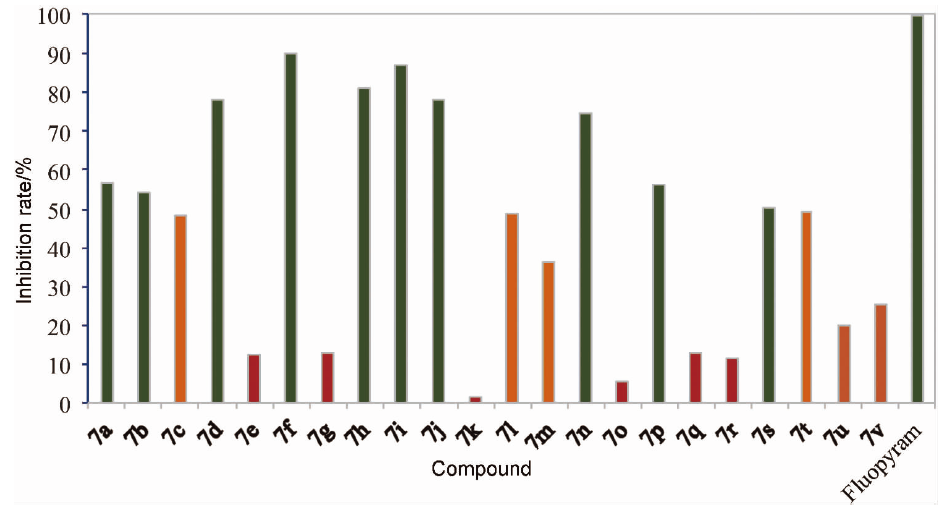
图 4 目标化合物对苹果腐烂病原菌的SDH酶活性(100 μmol•L-1)
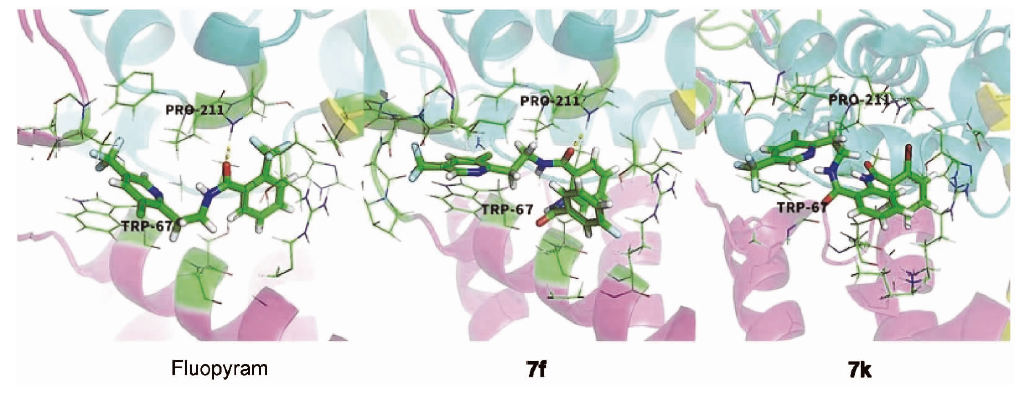
图 5 目标化合物与SDH酶分子对接图
1.6 分子对接
为了探究目标化合物与靶标酶之间的结合方式,对化合物7f和7k以及氟吡菌酰胺进行了分子对接。从蛋白质结构数据库种选取SDH晶体(4ysz)作为蛋白受体模板,经过去除水分子、加氢等处理后进行分子对接,结果如图5所示。化合物7f与酶的结合方式与氟吡菌酰胺的结合方式类似,化合物7f的吡啶环深入到活性口袋的疏水区,与Trp67形成π-π相互作用,酰胺键的氧原子与Pro211形成氢键相互作用。与氟吡菌酰胺不同的是,氟吡菌酰胺的氢键长度为0.2 nm,而7f形成的氢键长度为0.18 nm,由于双酰胺结构的引入导致酰胺键发生了一定程度的翻转,从而拉近了与关键氨基酸的距离,从而增强了化合物与靶酶的相互作用力。反观7k,由于邻位溴原子的引入导致分子的构象发生了较大程度的翻转,从而导致吡啶环不能在疏水区与Trp67形成π-π相互作用,并且翻转导致酰胺键的氧原子远离Pro211,从而不能形成氢键相互作用,这也是7k的杀菌活性差的原因,与实验结果一致。分子对接表明化合物7f与SDH会形成较强的相互作用力,与抑菌实验以及酶抑制活性实验结果一致。综合酶活性和分子对接结果可知,SDH酶可能是所合成目标化合物的潜在靶标。
2 结论
基于亚结构拼接原理,以氟吡菌酰胺为先导化合物,设计并合成了22个未见文献报道的新颖双酰胺衍生物,对目标化合物进行了抑菌活性、杀线虫活性以及酶活性的测定。实验结果表明,在浓度为200 mg/L时,化合物7f表现出中等的杀线虫活性,死亡率为87%。在50 mg/L浓度下,22个化合物对四种病原菌均表现出一定的杀菌活性,其中7f对苹果腐烂病原菌的抑制率为92.5%,EC50为6.12 mg/L,超过阳性对照氟吡菌酰胺。目标化合物对苹果腐烂病原菌SDH酶活性与抑菌活性趋势一致。分子对接研究揭示SDH可能是新合成双酰胺衍生物的潜在靶标。 (来源:《有机化学》2021年第10期)
农药快讯, 2021 (14): 16-19; 29.